IMBRUVICA[much]新兩項臨床研究成功,有望擴大適應癥IMBRUVICA[much]新兩項臨床研究成功,有望擴大適應癥
![IMBRUVICA[much]新兩項臨床研究成功,有望擴大適應癥](/images/upload/Image/20161207110549krn2ps.jpg)
在圣地亞哥舉行的第58屆美國血液學會(ASH)年會上,生物制藥公司AbbVie公布了IMBRUVICA(ibrutinib)的兩項[much]新臨床研究的積極結果。
今天,AbbVie以口頭報告形式公布了IMBRUVICA(ibrutinib)的2期臨床研究PCYC-1129的[outstanding結果,在慢性移植物抗宿主病(cGVHD)患者中評估了其療效。這些病人在干細胞或骨髓移植后呈現嚴重身體健康衰弱,經全身性治療后失敗。研究發現IMBRUVICA有效、產生持續性反應和減輕癥狀的嚴重程度,總體反應率(ORR)高達67%。IMBRUVICA是一種領域內一馬當先Bruton酪氨酸激酶(BTK)抑制劑,由AbbVie公司旗下Pharmacyclics和Janssen Biotech公司聯合開發和市場化。藥明康德集團企業合全藥業也參與協助了這款新藥的合成。
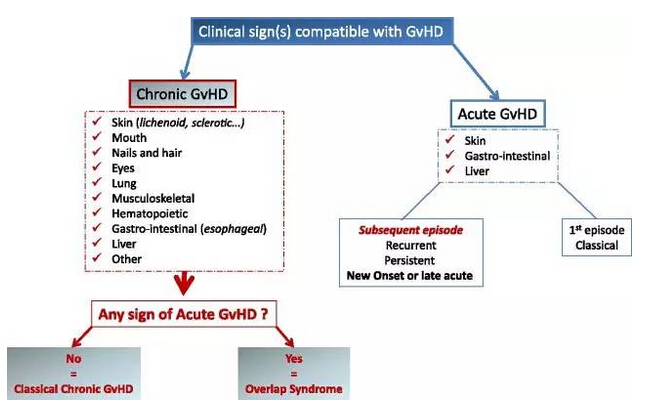
▲GVHD的臨床分類(圖片來源:《Blood》)
GVHD是一種危及生命的病癥,由于患者經歷同種異體干細胞或骨髓移植后,身體受到供體免疫細胞的攻擊而發生。GVHD可以是急性或慢性的; 慢性GVHD(cGVHD)通常在移植后3個多月開始,并且可以持續許多年。癥狀可以包括皮膚問題、脫發、口腔潰爛、眼部刺激,嚴重肺損傷或肝功能障礙。針對那些一線糖皮質激素治療失敗后,仍然需要額外護理的cGVHD患者,目前尚未有獲得批準的治療方案。大多數cGVHD患者被給予高劑量的糖皮質激素處方治療,這是一種抑制免疫系統并與其他并發癥發病率和復發高度相關的全身性類固醇。
IMBRUVICA是一種口服型每日一次的治療手段,可抑制一類被稱為Bruton的酪氨酸激酶(BTK)蛋白質。BTK是B細胞受體信號轉導復合物中的關鍵信號分子,在惡性B細胞的存活和擴散中起重要作用。IMBRUVICA可有效阻斷惡性B細胞不可控繁殖和擴散的細胞信號,幫助殺死并降低癌細胞數量,延緩癌癥的惡化。
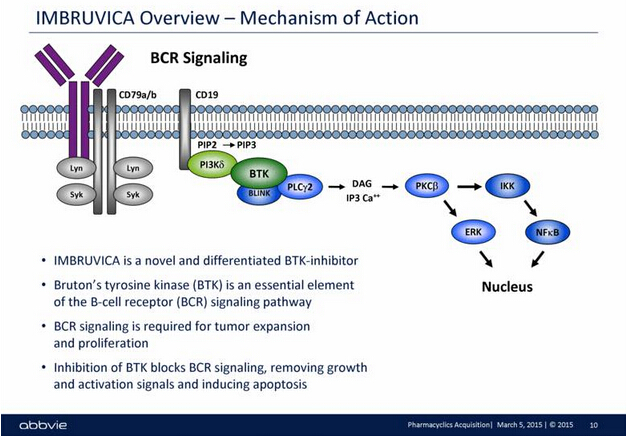
▲IMBRUVICA的作用機理(圖片來源:SEC)
在美國,IMBRUVICA此前曾獲批用于:復發性或難治性套細胞淋巴瘤(MCL)、經治慢性淋巴細胞白血病(CLL)、攜帶17p刪除突變的CLL、Waldenstrom巨球蛋白血癥(WM)。今年[much]新獲批的適應癥為一線治療CLL和作為單藥或聯合苯達莫司汀+利妥昔單抗(BR)用于伴有或不伴有染色體17p刪除突變(del 17p)的SLL患者。
PCYC-1129臨床試驗在42名cGVHD患者(中位年齡56歲)中評估了IMBRUVICA的安全性和功效,他們至少有過一種先前治療失敗(包括皮質類固醇)。患者每天使用IMBRUVICA,直到cGVHD進展或達到不可接受的毒性。主要終點是基于國立衛生研究院(NIH)共識標準而設定的cGVHD反應。次要終點包括持續反應率、Lee cGVHD癥狀量表、皮質類固醇需求隨時間的變化和安全性終點的變化。
在42名患者中位隨訪14個月時,研究發現ORR為67%。所有反應者中有三分之一達到完全緩解(CR)。此外,71%的患者表現出至少5個月的持續反應。在所有相關的器官中都觀察到相似的反應率,多器官移植的患者通常在多個器官中都有反應。 在研究過程中,61%的反應者有了臨床意義上的癥狀改善,如通過LeecGVHD癥狀量表測量,評分至少降低7點。此外,62%的所有患者能夠將類固醇劑量降低至可接受的低達水平。
昨天,AbbVie還公布了另外一項IMBRUVICA的2期有效性和安全性研究結果,數據表明近一半(48%)的復發/難治性(R/R)邊緣區淋巴瘤(MZL)患者對IMBRUVICA單藥具有完全或部分應答,結果是由獨立審查委員會(IRC)研究者評估的。
MZL是在淋巴組織邊緣處由白細胞(淋巴細胞)產生的緩慢生長的多樣化非霍奇金淋巴瘤。MZL約在成年人中占所有非霍奇金淋巴瘤病例的12%,并且中位年齡診斷為65歲。針對MZL患者,目前還沒有獲得批準的治療方案和治療標準。
這個2期研究在R/R MZL患者中評估了IMBRUVICA的安全性和功效。試驗的主要目的是衡量由IRC評估的ORR。反應持續時間(DOR)、無進展生存期(PFS)、總生存期(OS)和安全性是次要目標。本研究的數據于2016年9月提交給美國FDA,作為補充新藥申請(sNDA)的一部分,以擴大IMBRUVICA的現有適應癥。
在該多中心、開放標記試驗中,63名MZL患者(包括脾MZL、淋巴結MZL、和淋巴結外MZL亞型)接受一種或多種先前治療,包括至少一種CD20-介導免疫治療方案或利妥昔單抗治療。在研究中,79%的患者經歷了部分腫瘤減少(63個患者中的50個),總體反應率(ORR)為48%,這意味著BTK信號傳導是MZL中的重要生長和存活因子。初始反應的中值時間為4.5個月。
我們衷心祝愿IMBRUVICA能夠獲得更廣的適應癥標簽,造福更多的癌癥患者群體。


